消息,2024年7月25日泽璟制药(688266)发布公告称公司于2024年7月16日召开分析师会议,长江证券、诺安基金、中信保诚保险、世诚投资、汇安基金、观富资产、仁布资产、汇添富基金、摩根基金、东方红、嘉实基金、中信建投证券、南华基金、建信养老、人保资产、国联证券、丹羿投资、建信基金、东吴证券、西部证券、大摩华鑫、西部利得、富国基金、华安基金、东海自营、华宝基金、招银理财、汇添富、朱雀基金、红杉资本、华夏基金、民生通惠、鹤禧基金、国君资管、盘京投资、长盛基金参与。
具体内容如下:
问:看到公司关于进一步收购子公司GENSUN的公告,请更新GUNSUN的定位和发展情况?
答:进一步收购GENSUN是公司为了履行公司首次公开发行股票并上市时关于消除潜在利益冲突的承诺。GENSUN定位为公司在美国的新药研发中心,目前GENSUN公司研发的多个候选抗体新药取得了实质性的进展,其中包括ZG005(抗PD-1/TIGIT双特异抗体)、ZG006(抗CD3/DLL3/DLL3三特异抗体)、ZGGS18(VEGF/TGF-β双功能抗体融合蛋白)、ZGGS15(抗LG-3/TIGIT双特异抗体)等已经获得中国和美国监管机构的临床试验许可,并处于临床研究阶段,特别是ZG005和ZG006已在早期临床研究中初步展现出治疗肿瘤的优异疗效数据和安全耐受性,具有成为FIRST-IN-CLSS和BEST-IN-CLSS的潜力。本次收购完成后,将进一步增强公司对GENSUN的管理和控制,提高决策效率,实现公司持续、健康发展;更重要的是,将进一步加强公司全球研发策略的制定和执行,实现中国和全球研发整体协调发展,加快公司新药研发的全球布局,更好地满足公司新药的全球研发定位,提升公司参与国际新药开发竞争的能力。
问:请介绍ZG006的研发进展、预计部分数据读出时间和开发计划?
答:ZG006是全球第一个针对DLL3表达肿瘤的三特异性抗体(CD3×DLL3×DLL3),是全球同类首创(First-in-Class)分子形式,具有成为同类最佳(Best-in-Class)分子的潜力。ZG006用于治疗晚期实体瘤的临床试验申请已获FD和NMP批准,目前处于I期的剂量爬坡阶段,入组进度顺利,符合预期。有关ZG006临床试验的相关数据,将在后续相关学术会议上公布,目前公司已向2024 ESMO会议投稿并被接收。基于DLL3是一种在正常细胞中极低表达,而在小细胞肺癌(SCLC)、神经内分泌癌等肿瘤细胞中高表达的肿瘤特异性抗原,公司将重点在小细胞肺癌、神经内分泌癌等领域进行开发和研究。
问:请公司ZG005在ASCO发布的临床研究数据情况和展望?
答:ZG005在2024年美国临床肿瘤学会(SCO)年会发布的I/II期临床研究数据及最新进展截至2024年4月16日,ZG005-001项目剂量递增阶段已完成,共入组32例受试者;剂量扩展阶段正在进行中,已入组47例受试者。79例受试者中,43%的受试者既往曾接受过至少两线抗肿瘤药物系统治疗,48%的受试者既往接受过PD-1/PD-L1抑制剂治疗。有效性方面,可评估疗效的21例宫颈癌受试者(3 mg/kg组1例、10 mg/kg组12例、20 mg/kg组8例)中,有2例完全缓解(CR)、7例部分缓解(PR)和8例疾病稳定(SD);客观缓解率(ORR)为43%(9/21),疾病控制率(DCR)为81%(17/21),特别是目标剂量20 mg/kg组的客观缓解率(ORR)达到63%。9例获得客观缓解(CR/PRs)的宫颈癌受试者中,2例既往接受过PD-1/PD-L1抑制剂治疗。1例3 mg/kg组宫颈癌受试者,其肿瘤病灶自首次给药后持续缩小,现已接受ZG005治疗超过77周,靶病灶总径较基线缩小60.9%。11例宫颈癌受试者在首次肿瘤评估时即出现肿瘤缩小。截至数据截止日期,有16例受试者仍正在接受治疗。安全性方面,63.3%(50/79)的受试者出现了与治疗相关的不良事件(TREs),绝大多数严重程度为1或2级。综上,ZG005呈现出良好的耐受性和安全性及良好的抗肿瘤疗效,特别是在接受20 mg/kg剂量治疗的晚期宫颈癌患者中初步结果显示疗效更优。现有已获得的有效性和安全性数据支持ZG005在晚期宫颈癌等多瘤种中开展进一步的临床研究。根据公开查询,ZG005是全球率先进入临床研究的同靶点药物之一,目前全球范围内尚未有同类机制药物获批上市。
问:请介绍一下吉卡昔替尼治疗斑秃的临床进展情况,以及后续数据公布时间?
答:《盐酸杰克替尼片治疗重症斑秃患者的有效性和安全性的多中心、随机、双盲、安慰剂平行对照 III 期临床试验》(方案编号ZGJK018)在北京大学人民医院、中国医学科学院皮肤病医院等44家医院开展,符合方案要求的425例重症斑秃患者随机入组,分配到吉卡昔替尼片50mg Bid 组、75mg Bid组或安慰剂片组,经独立第三方非盲团队对该项试验中完成 24周治疗的数据进行分析后,结果显示主要疗效终点,即治疗24周脱发严重程度工具量表(SLT)评分≤20分的受试者百分率,吉卡昔替尼片两组均显著优于安慰剂组,达到统计显著性(p<0.0001)。安全性方面,吉卡昔替尼治疗重症斑秃患者的安全性与耐受性良好。公司将加快推进盐酸吉卡昔替尼片治疗重症斑秃患者适应症的上市进程。目前,吉卡昔替尼治疗重症斑秃III期临床研究的延伸试验(方案编号ZGJK020)正在进行中。有关该项临床试验的详细数据,将在后续相关学术会议上公布。
问:重组人促甲状腺激素目前进展情况和应用场景?
答:公司已向国家药监局递交了注射用重组人促甲状腺激素(rhTSH)递交了生物制品上市许可申请并获得受理,公司将开展相关工作,配合药监部门开展审评审批。本次受理新药上市申请的适应症是用于既往接受过甲状腺切除术的分化型甲状腺癌患者随访时的放射性碘(131I)全身显像(WBS)检查和血清甲状腺球蛋白(Tg)检测。截至目前,国内尚未有重组人促甲状腺激素获批用于该项适应症。注射用重组人促甲状腺激素(rhTSH)应用场景为对于甲状腺癌患者诊疗过程一般包括手术切除、I-131放疗、系统治疗等。分化型甲状腺全切或近全切手术后的诊疗,I-131治疗和定期随访是获得更长生存的关键手段之一。外源性注射人重组促甲状腺素是比现有甲状腺素撤除(THW)更加快速和安全地提高甲状腺癌诊断和治疗水平的方法。相较于现有的甲状腺素撤除(THW)方法(如停用优甲乐2~4周),注射重组人促甲状腺激素提升TSH时间更快(仅需2天左右),并且避免甲减导致体重增加、畏寒等不良反应以及相关并发症的恶化,降低肿瘤进展风险,因此是临床上甲状腺癌诊断和治疗的更优选择。
问:吉卡昔替尼在自身免疫性疾病领域的研发进展?
答:在自身免疫性疾病领域,吉卡昔替尼片治疗重症斑秃的III期临床研究已达到主要疗效终点,公司将加快推进盐酸吉卡昔替尼片治疗重症斑秃患者适应症的上市进程,该适应症的研发进度位于国产JK抑制剂的前列;同时,吉卡昔替尼片治疗中重度特应性皮炎和强直性脊柱炎的III期临床试验也在加快推进中,吉卡昔替尼片治疗特发性肺纤维化、中重度斑块状银屑病等自身免疫相关疾病的II期临床试验正在开展中。在治疗白癜风适应症方面,吉卡昔替尼乳膏和吉卡昔替尼片剂用于治疗12岁及以上青少年和成人非节段型白癜风患者的临床试验已经获得NMP批准。
问:请公司ZGGS18在ASCO发布的临床研究数据情况?
答:ZGGS18在2024年美国临床肿瘤学会(SCO)年会发布的I/II期临床研究数据及最新进展 截至2024年4月23日,共入组21例受试者;其中男性14例,女性7例;ECOG评分1分16例,0分5例;所有受试者既往均至少接受过一线治疗。有效性方面,共19例疗效可评估受试者,ORR和DCR分别为5.3%和42.1%。6 mg/kg剂量组1例子宫内膜癌患者已接受了22次ZGGS18治疗。20 mg/kg剂量组1例既往接受过四线治疗失败的直肠癌患者,在第18周肿瘤评估时靶病灶缩小39.8%,达到PR。安全性方面,81.0%(17/21)例受试者发生了治疗相关不良事件(TRE),绝大多数为1或2级。综上,ZGGS18呈现出良好的耐受性和安全性以及抗肿瘤疗效,支持ZGGS18在晚期肿瘤中开展进一步的临床研究。
泽璟制药(688266)主营业务:化学新药及生物新药的研发、生产及销售。
泽璟制药2024年一季报显示,公司主营收入1.08亿元,同比上升0.12%;归母净利润-3949.94万元,同比上升30.98%;扣非净利润-4250.29万元,同比上升33.51%;负债率48.44%,投资收益50.59万元,财务费用-696.08万元,毛利率93.4%。
该股最近90天内共有10家机构给出评级,买入评级9家,增持评级1家;过去90天内机构目标均价为62.46。
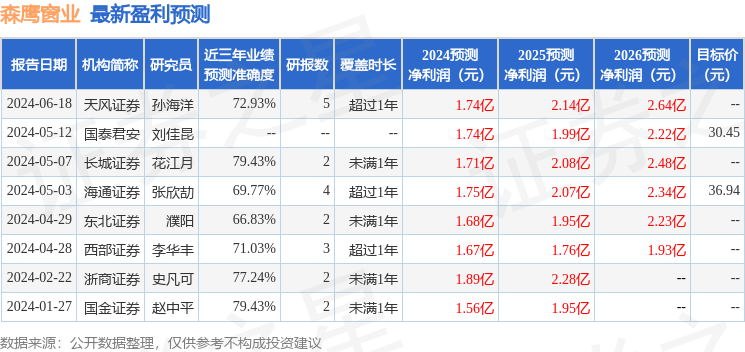
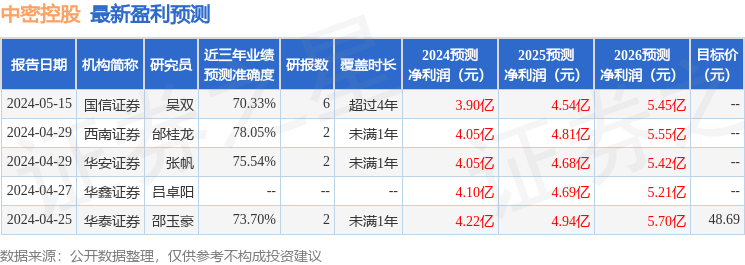
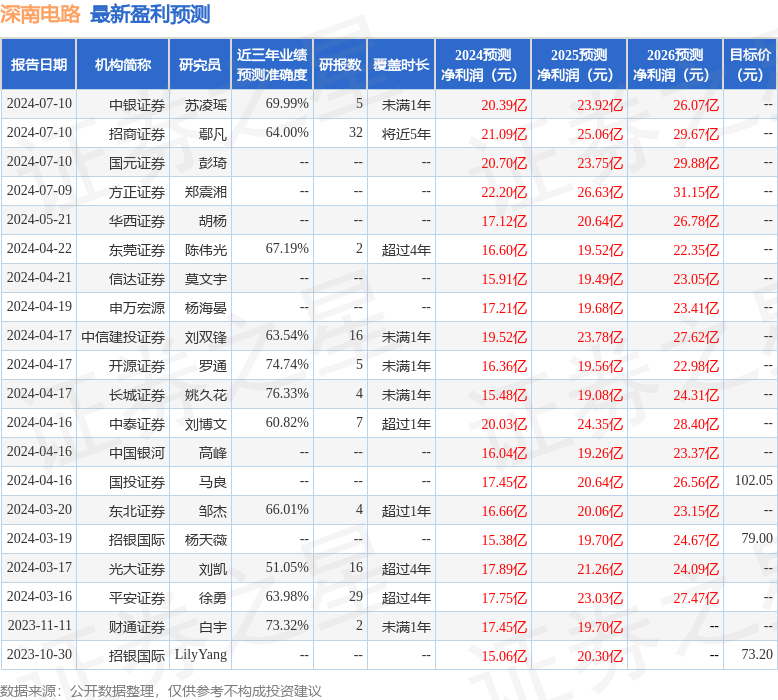
以下是详细的盈利预测信息:

融资融券数据显示该股近3个月融资净流入216.08万,融资余额增加;融券净流出3223.94万,融券余额减少。
以上内容由根据公开信息整理,由算法生成(网信算备310104345710301240019号),与本站立场无关,如数据存在问题请联系我们。本文为数据整理,不对您构成任何投资建议,投资有风险,请谨慎决策。