-掩蔽型抗CTLA-4安全抗体SAFEbody® ADG126(muzastotug)联合抗PD-1针对转移性微卫星稳定型(MSS)结直肠癌(CRC)治疗,在更高剂量、更高频率的多次重复给药方案中验证其临床获益,数据凸显了潜在同类最佳-
-将正在进行的针对MSS CRC 2期与 PD-1的联合剂量扩展队列扩大到超过50名患者,其中包括启动新的20 mg/kg的起始负荷剂量组,预计在2024年公布数据-
-安全抗体SAFEbody掩蔽技术通过与Exelixis和赛诺菲的合作进一步获得验证,表明天演技术平台在抗体偶联药物、双特异性与单克隆抗体等领域具有广泛的适用性-
-现金结余约1.1亿美元,可支持公司至2026年的运营-
Ib/2期数据表明,掩蔽型安全抗体SAFEbody ADG126结合独特的CTLA-4表位,基于CTLA-4的生物学基础,靶向肿瘤组织内调节性T细胞(Tregs)与默沙东抗PD-1药物帕博利珠单抗(KEYTRUDA®)联合疗法在针对MSS CRC、经PD-1治疗失败后出现进展以及PD-L1低表达肿瘤中显示出同类最佳潜力。
在2024年美国临床肿瘤学会胃肠道癌症(ASCO-GI)研讨会上公布的ADG126联合帕博利珠单抗(200 mg,每三周一次)的剂量递增与剂量扩展队列试验结果表明,ADG126在6 mg/kg至10 mg/kg的剂量范围内对经过大量多线治疗的晚期/转移性患者(N=46)具有差异化的安全性:
观察到有限的剂量依赖性毒性。
46名患者中,5名(10.8%)出现3级治疗相关不良事件(TRAE),未出现4级与5级治疗相关不良事件,中断率为6.5%(3/46)。
在针对不同肿瘤类型的剂量递增试验中,从3名接受剂量水平为10 mg/kg且每3周给药的ADG126治疗的患者身上观察到两例确认的部分缓解(PR),其中一名为经PD-1治疗耐药的宫颈癌患者,另一名子宫内膜癌患者。由此启动该给药方案的扩展队列。两例已确认的部分肿瘤缓解已持续超过一年,同时治疗方案显示了优异的安全性。
在针对MSS CRC的剂量扩展试验中,12名无肝转移的可评估患者接受剂量水平为10 mg/kg且每3周给药的强效治疗;
从其中9名无腹膜和肝转移的患者身上观察到两例确认的部分缓解,该组患者的总缓解率为22%。
这9名患者中有7名出现病情稳定(SD),总疾病控制率100%(2例部分缓解,7例病情稳定)。
根据Simon的两阶段设计,基于临床结果将该剂量水平的试验计划推进至第二阶段。
在对这些无肝和腹膜转移的MSS CRC患者的无进展生存期(PFS)初步分析中,接受10 mg/kg两个给药频率(每3周给药(n=9)和每6周给药一次(n=6))的ADG126治疗的患者的PFS中位数为7个月。随着一个更大型的患者队列在10 mg/kg、每3周给药试验中接受评估,ADG126联合帕博利珠单抗的持久临床疗效将得到进一步检验。
美国临床肿瘤学会胃肠道癌症研讨会后,天演公布了ADG126临床试验项目的进展和拓展,正在进行的2期剂量扩展队列将扩大到超过50名MSS CRC患者。项目的临床开发更新包含以下内容:
公司宣布正在进行的评估ADG126 10 mg/kg 每3周一次联合帕博利珠单抗治疗MSS CRC的2期剂量扩展队列已在2023年第四季度完成处于Simon两阶段设计的第二阶段的额外新增的12名患者入组。以上第二阶段的结果有望进一步验证近期在2024年美国ASCO-GI研讨会上公布的该队列第一阶段研究数据。
鉴于ADG126的安全性,天演还启动了针对20 mg/kg负荷剂量下ADG126联合帕博利珠单抗治疗晚期/转移性癌症患者的评估。公司目前正对这一给药方案进行安全性评估,并计划在随后开展的美国和亚太地区MSS CRC患者的扩展队列中评估20 mg/kg负荷剂量后10 mg/kg每3周一次维持剂量下联合帕博利珠单抗治疗的有效性。
公司已获国家药品监督管理局药品审评中心(CDE)批准于中国启动ADG126联合帕博利珠单抗的临床评估。这将有利于天演在和默沙东临床合作项目上于更多MSS CRC患者群体及潜在其他肿瘤类型中评估该联合疗法的疗效。
此外,近期公司在中国已启动开展针对晚期/转移性癌症患者进行 ADG126 30 mg/kg 每3周一次单药治疗评估,以确定 ADG126 单药治疗的潜在最大耐受剂量。
Ib/2期数据表明,靶向独特表位的抗CTLA-4非掩蔽型新表位抗体NEObody™ ADG116在单一疗法以及与抗PD-1的联合疗法中均显示出良好的安全性与临床缓解。
ADG116单一疗法在最高剂量达到15mg /kg(N=59)的试验中显示出良好的安全性,并且其总缓解率(ORR)达到13%(3/23可评估),包括在多个不同肿瘤类型的患者中观察到确认的持久肿瘤缓解。
与抗PD-1疗法(N=22)的联合治疗试验结果表明,在剂量水平为3 mg/kg且每6周给药一次的剂量递增试验中,ADG116展现出可控的安全性与令人鼓舞的有效性。正在进行的联合治疗队列中观察到临床缓解,其中,一位头颈部鳞状细胞癌(HNSCC)患者在剂量水平为3mg /kg(最初每3周给药一次,然后每6周给药一次)的ADG116与特瑞普利单抗联合治疗的重复给药试验中观察到持续近两年的持久完全缓解(CR)(ORR = 20%;1/5可评估)。此外,一位MSS CRC患者在ADG116(剂量水平为3mg /kg,每6周给药一次)与特瑞普利单抗联合治疗的重复给药试验中观察到初步部分缓解,进一步验证与靶向独特的CTLA-4表位有关的临床效益和调节性T细胞清除对疗效的关键意义。
ADG116已观察到临床疗效,并准备在合理配备资源后进入更深入的临床开发。
经过 Fc 端优化的抗 CD137 IgG1 掩蔽型POWERbodyTM强力抗体ADG206针对晚期/转移性肿瘤患者的临床I期正在进行中:
正在进行的 1 期临床试验已招募 10名患者,以评估新一代抗 CD137 候选药物的安全性、有效性和耐受性。目前正在开展剂量水平为3 mg/kg且每3周给药一次的剂量递增试验。尚未达到最大耐受剂量(MTD)。
临床前数据表明,ADG206在多种肿瘤模型的单药治疗中具有良好的耐受性与稳定的抗肿瘤活性,在最大耐受剂量为 0.1 mg/kg每三周一次给药时,激活抗体对CD137激动型活性和T细胞共刺激比基准抗体(urelumab类似物)强4倍。
新一代抗CD137候选抗体ADG206是首个进入临床开发阶段的经过Fc端优化的掩蔽POWERbody™强力抗体候选药物,结合公司精准掩蔽、Fc端优化与创新表位技术,以应对抗CD137疗法的安全性与有效性挑战。
Exelixis:根据双方为开发原创掩蔽型抗体偶联药物而达成的技术授权协议,2023年6月,天演在第二个合作项目中成功筛选到目标安全抗体SAFEbody®候选药物,并获得一笔来自Exelixis的300万美元里程碑付款。
赛诺菲:天演与赛诺菲合作开发双特异性和单克隆SAFEbody®候选抗体,利用天演的安全抗体SAFEbody精准掩蔽技术研发临床前候选抗体,由赛诺菲进行开发和商业化。此项合作于2022年3月公布,包括一笔1750万美元的首付款,用于首先启动两个项目,和一笔提名额外两个项目的附加费用,还包括最高可达25亿美元的潜在里程碑付款,以及分级特许权使用费。
罗氏:罗氏赞助并开展一项跨国1b/2期临床试验,评估ADG126联合阿替利珠单抗和贝伐珠单抗之三联免疫疗法在晚期肝细胞癌(HCC)的一线治疗中的效用。天演保留对ADG126的全球开发与商业化权利。
Grawunder博士将以独立董事的身份加入公司董事会,并成为审计委员会和战略委员会成员。Grawunder博士是瑞士/德国资深生命科学企业家,在治疗性抗体开发行业拥有超过20年的经验。
现独立董事朱力博士将成为董事会薪酬委员会成员。
张耀梁先生、Mervyn Turner博士与谭文健先生的董事任期将继续延长。
现独立董事,审计委员会、薪酬委员会与提名和公司治理委员会成员利民博士,以及生物信息科技高级副总裁,现董事会成员李艳女士因个人原因将辞去董事会和相关委员会成员职务。李艳女士将于2024年6月15日正式退出董事会,未来将继续担任董事会观察员。利民博士与李艳女士均确认与董事会不存在分歧,关于二人的退出没有其他需要公司股东关注的问题。
正在进行的ADG126联合帕博利珠单抗的1b/2期临床试验,包括MSS CRC剂量扩展队列数据预计将在2024年逐步公布:
第一部分10 mg/kg、每3周给药 (n=12)和10mg /kg、每6周给药(n=10)可评估患者的随访研究数据
第二部分10 mg/kg、每3周给药(n=12)的患者数据
应美国FDA Optimus计划的要求评估不同剂量包括20 mg/kg负荷剂量
重复给药的安全性数据
MSS CRC患者(n~10)的剂量扩展数据
中国地区的更多患者数据(n≥10)
达成更多技术授权合作和/或里程碑。
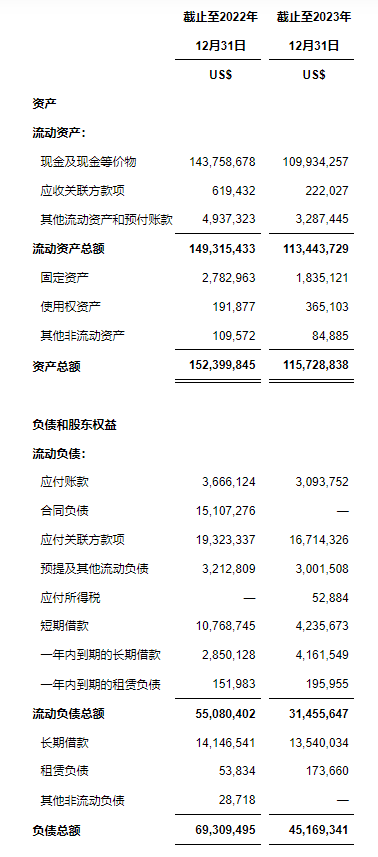
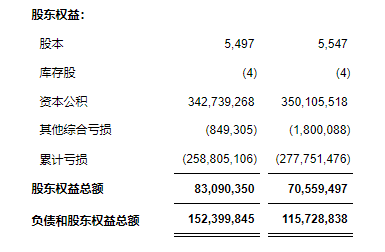
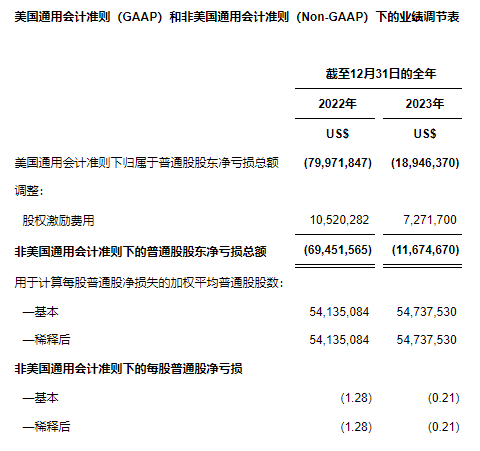
未经审计的合并利润表(美国通用会计准则)