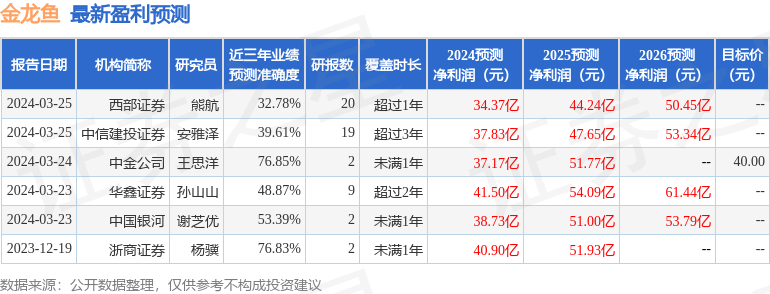
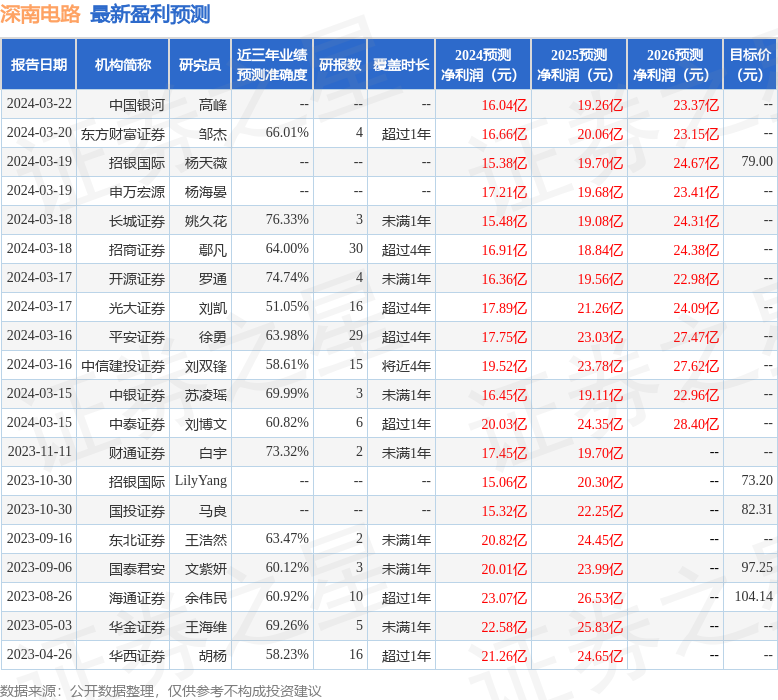
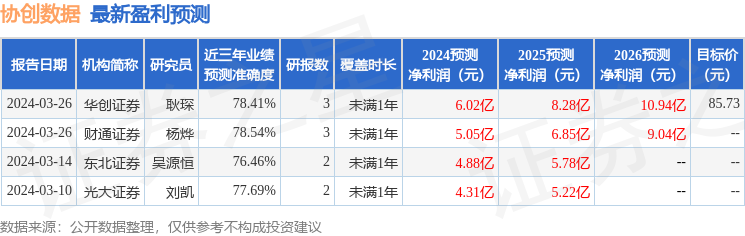
消息,2024年3月27日康乐卫士(833575)发布公告称平安资管、华宝基金、红骅投资、国都资管、湘财证券、国联基金、翊丰资产、汇添富、向日葵投资、泰康资产、首创证券、申万宏源证券、北京信托、西部利得、兴合基金于2024年3月25日调研我司。
具体内容如下:
问:三价HPV疫苗预计2024年交BLA的依据是什么?
答:我们的依据包括以下三点首先,公司的三价HPV疫苗Ⅲ期效力临床 共招募并入组了8,880名受试者,较在售国产二价HPV疫苗馨可宁的效力临床入 组人数更多,旨在通过更大的样本量缩短合格病例的收集周期;其次,相比二价 HPV 疫苗,公司的三价HPV疫苗除覆盖HPV16和18型外,还覆盖了诱发东亚地 区宫颈癌的第三大高危亚型HPV 58型,按照组织病理学复合终点,三价HPV疫 苗的Ⅲ期临床的合格病例除包括因感染HPV16和18型感染引发的CIN2+病例外, 还包括因感染58 型感染而引发的CIN2+病例;最后,考虑到公司目前已积累的 CIN2+病例数和其他已获上市许可的 HPV 疫苗的中期分析时间表(从第一剂后 14.8 个月到48个月不等)。公司认为有望在2024年提交其三价HPV候选疫苗的 BL。
问:公司目前的治疗型HPV疫苗进展如何?
答:公司的mRN二价治疗性HPV疫苗是根据HPV16型及18型的致癌基因 E6 和E7 序列设计。初步动物实验研究表明,公司的mRN二价治疗性HPV疫苗 可有效激活杀伤性 CD8+T 细胞(CTL)并清除小鼠体内的肿瘤。公司预计于 2025 年向CDE提交mRN二价治疗性HPV疫苗的IND申请。
问:公司疫苗的定价策略是什么?
答:我们的三价HPV疫苗未来若在中国上市,将成为九价HPV疫苗以下的 低价次疫苗中对东亚地区女性而言保护范围最广的HPV疫苗。公司预计三价HPV 疫苗的定价会高于目前市售的国产二价HPV疫苗,低于目前市售的进口四价HPV 疫苗;我们的九价HPV疫苗未来若在中国和印尼上市,预计定价会低于目标市场 的默沙东九价HPV疫苗的售价。上市产品的最终定价将依据产品成本、目标人群、 市场结构、竞品价格和竞争态势等因素变化进行调整。
问:国内男性HPV接种率如何,公司九价HPV疫苗(男性适应症)何时 交BLA?
答:目前中国尚无HPV疫苗产品获批男性适应症。HPV病毒感染与男性尖 锐湿疣,肛门癌、阴茎癌、口咽等头颈部癌症高度相关。男性接种HPV疫苗不仅 可以避免其作为载体导致的HPV病毒传播,也可以预防因感染HPV病毒而引起的 上述相关疾病,对公共卫生事业意义重大。WHO发布的立场文件指出,在满足主 要目标人群接种需求后,如资源充分,可考虑男性人群的接种。根据WHO网站和 弗若斯特沙利文数据,部分发达国家如澳大利亚和加拿大的15岁以下男性HPV 疫苗接种率,已分别达到77%和81%。2022年,中国有3.35亿男性适合接种HPV 疫苗,中国HPV疫苗男性适应症市场空间巨大,市场潜力有待开发和释放。 我们是首家开展九价HPV疫苗男性保护效力临床试验的国产疫苗开发商。公 司九价HPV疫苗(男性适应症)Ⅲ期临床试验于2022年12月正式启动,已完成 全部受试者入组及大部分受试者第一剂次免后7个月访视。我们预计将于2027 年提交九价HPV疫苗(男性适应症)的BL。
问:公司未来商业化的准备和销售规划?
答:公司在优质高效推进产品临床试验进程,确保如期达到临床终点的同 时,同步启动了产业化基地与商业化网络建设,保证产品如期商业化。 公司在2021年启动了HPV疫苗产业化基地建设。产业化基地项目分两期建 设,其中项目一期已建设完成并交付使用。公司已于2023年8月1日启动技术 转移与试生产。公司昆明生产基地按中国、欧盟和世卫组织的GMP标准设计建设, 设计年产能为1,000万支三价HPV疫苗和3,000万支九价HPV疫苗。公司预计昆 明生产基地将于2024年下半年申请药品生产许可证,确保公司产品获得BL批 准后能立即开展商业化生产。 公司已在两年前启动商业化团队和市场营销体系建设等准备工作。公司将结 合产品上市时间,在BL申报同时建设自营团队,结合全国不同区域与不同文化 背景,制定产品优势科普和消费者教育等宣传推广计划,通过各类学术研讨会和 疫苗领域专业会议等活动塑造和提升品牌影响力。同时,公司还将与行业领军企 业或合约销售组织(Contract Sales Organization)合作开展疫苗产品的商业 化推广,通过联合推广模式触达更多医疗保健专业人士及疫苗接种点。
问:公司目前的现金状况以及未来联交所发行计划如何?
答:截至2023年末,公司货币资金为人民币140,144,976.77元,货币资 金较上年期末减少 78.94%,主要系公司日常经营活动现金流出、长期资产投资 现金流出所致。目前公司募集资金、存量资金以及通过银行贷款等方式筹集的资 金,可以满足公司当前的资金需求。后续不排除通过间接融资、再融资或其他方 式筹资以满足未来项目研发和商业化的资金需求。 公司已于2024年1月29日正式向香港联交所递交H股上市申请并刊发申请 资料。本次公司拟申请发行不低于 49,577,648 股 H 股新股(超额配售权行使 前),即不低于本次发行后公司总股本的15%(超额配售权行使前),并根据市场 情况授予承销商不超过前述发行的H股股数15%的超额配售权。目前公司联交所 IPO 项目正处于联交所审核及中国证监会备案过程中。问题 7公司的九价疫苗未来可能受益于最新发布的技术指导原则加速上 市,请介绍一下PI12病毒学终点?绝大多数HPV 感染都是无症状一过性感染,极少数(~10%)HPV 感 染可在人体内持续(Persistent Infection,PI)并引发疾病。PI 是导致组织 病理学改变的发病和进展机制。根据2023年7月国家药监局药审中心发布的《人 乳头瘤病毒疫苗临床试验技术指导原则(试行)》,HPV疫苗临床试验方案需严格 制定PI12 的定义,包括但不限于采样时间间隔、样本来源、检测方法、是否存 在访问缺失等可能影响试验质量的关键要素。一般情况下,PI12 定义为在同一 受试者相隔6(±1)个月采集的宫颈/阴道/外生殖器拭子、活检组织中,连续3 次及以上经聚合酶链式反应(PCR)发现同一HPV型别核酸阳性。 公司九价HPV疫苗女性Ⅲ期保护效力临床试验中设定PI12为共同主要终点 之一,其定义符合《人乳头瘤病毒疫苗临床试验技术指导原则(试行)》的规定。
问:了解到公司九价小年龄段临床试验数据,与市售产品结果相当。请 具体情况如何? 回
答:我们在2022年3月启动了针对9至26岁女性的九价HPV疫苗免疫桥 接临床试验,其中9-14岁女性两剂组按0-6月免疫程序接种2剂次试验疫苗, 9-19 岁女性三剂组按0-2-6月免疫程序接种3剂次试验疫苗,分别入组640人; 20-26 岁女性入组1,470人,按11的比例随机接种3剂次试验疫苗或阳性对照 疫苗Gardasil9;在最后一剂给药后对受试者进行为期66个月的访视。 我们的九价HPV疫苗女性小年龄组免疫桥接临床试验首次分析结果表明,受 试者完成末剂接种一个月后,我们九价HPV疫苗产生了相较于Gardasil9非劣的 免疫反应。在九价HPV疫苗覆盖的9种HPV型别中,我们的候选疫苗产生的针对 其中6种HPV病毒的中和抗体滴度在数值上更高。
康乐卫士(833575)主营业务:基于结构设计的重组蛋白疫苗研究、开发和产业化。
康乐卫士2023年年报显示,公司主营收入177.97万元,同比下降6.36%;归母净利润-3.01亿元,同比下降2.76%;扣非净利润-3.14亿元,同比下降6.67%;其中2023年第四季度,公司单季度主营收入17.86万元,同比下降82.37%;单季度归母净利润-7604.38万元,同比上升7.49%;单季度扣非净利润-7628.51万元,同比上升7.89%;负债率37.64%,财务费用-418.81万元,毛利率95.58%。
该股最近90天内无机构评级。融资融券数据显示该股近3个月融资净流出87.41万,融资余额减少;融券净流入0.0,融券余额增加。
以上内容由根据公开信息整理,由算法生成,与本站立场无关。力求但不保证该信息(包括但不限于文字、视频、音频、数据及图表)全部或者部分内容的的准确性、完整性、有效性、及时性等,如存在问题请联系我们。本文为数据整理,不对您构成任何投资建议,投资有风险,请谨慎决策。