消息,2024年2月6日君实生物(688180)发布公告称公司于2024年2月5日接受机构调研,国泰君安证券、重庆德睿恒丰资产、中欧基金、兴业证券、汇添富基金、花旗银行、泰康资产、长江证券、大家资产、中信证券资管参与。
具体内容如下:
问:特瑞普利单抗的最新出海进展?
答:2023年10月,特瑞普利单抗(美国商品名LOQTORZI?)的生物制品许可申请(BL)获得美国食品药品监督管理局(FD)批准。于2023年12月,头颈部肿瘤NCCN(美国国立综合癌症网络,NationalComprehensiveCancerNetwork)临床实践指南更新至2024.v2版,特瑞普利单抗联合顺铂/吉西他滨一线治疗复发性、不可切除或转移性鼻咽癌患者获得指南一类推荐,特瑞普利单抗单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性不可切除或转移性鼻咽癌患者获得指南唯一推荐。特瑞普利单抗成为全球首个入选NCCN鼻咽癌指南首选治疗方案的中国创新生物药。根据合作伙伴Coherus发布的新闻稿,Coherus已于2024年1月在美国推出LOQTORZI?。作为美国首个且唯一获批用于鼻咽癌治疗的药物,Coherus将持续加强医生教育与患者获取,致力将LOQTORZI?联合化疗建立为复发/转移性鼻咽癌的新治疗标准。海外上市申请方面(1)通过奥比斯项目(ProjectOrbis),2023年12月和2024年2月,特瑞普利单抗联合顺铂/吉西他滨作为转移性或复发性局部晚期鼻咽癌成人患者的一线治疗,以及作为单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌的成人患者的上市许可申请已分别获得澳大利亚药品管理局(TG)和新加坡卫生科学局(HS)的受理。此外,特瑞普利单抗用于治疗鼻咽癌还获得了TG授予的孤儿药资格认定。在ProjectOrbis的工作框架下,国际监管机构间的合作有助于肿瘤患者更早地获得来自其他国家的新疗法。特瑞普利单抗治疗鼻咽癌适应症是首个被纳入ProjectOrbis的国产肿瘤药,公司将在多个适用该路径的国家和地区探索快速上市的可能;(2)特瑞普利单抗一线治疗鼻咽癌和一线治疗食管鳞癌的上市许可申请已获得欧洲药品管理局(EM)和英国药品和保健品管理局(MHR)受理,正在审评过程中;(3)公司已与Hikma、Dr.Reddy’s、康联达生技等合作伙伴在中东和北非、拉丁美洲、印度、南非、东南亚、澳大利亚、新西兰等超过50个国家达成商业化合作。公司及各合作伙伴将尽快启动特瑞普利单抗在合作区域的上市申报进程,并积极探索更多适应症在部分地区上市的可能性。上述特瑞普利单抗在更多国家和地区的上市申请及审评进程具有不确定性,相关事项后续的重要进展请以公司公告为准。此外,PD-1抑制剂作为肿瘤免疫(I-O)战略的基石,旨在延长癌症患者的生存期,公司亦将探索特瑞普利单抗与其他I-O药物联用的可能性,包括特瑞普利单抗联合公司自主研发的tifcemalimab(抗BTL单抗)等,以拓展能够得到生存获益改善的癌症患者数量,并实现更多适应症在全球范围内的获批上市。
问:抗BTLA单抗临床进展?
答:2023年6月及2023年8月,FD及国家药品监督管理局(NMP)分别同意公司开展公司自主研发的全球首个进入临床开发阶段(first-in-human)的抗肿瘤抗BTL单抗tifcemalimab(项目代号TB004/JS004)联合特瑞普利单抗作为局限期小细胞肺癌(LSSCLC)放化疗后未进展患者的巩固治疗的随机、双盲、安慰剂对照、全球多中心III期临床研究(NCT06095583,研究代号JUSTR-001)。该研究为BTL靶点药物全球首个确证性研究,旨在评估tifcemalimab联合特瑞普利单抗对比特瑞普利单抗单药及对比安慰剂用于同步放化疗后未进展LS-SCLC患者的巩固治疗的疗效和安全性,由山东第一医科大学附属肿瘤医院于金明院士担任全球主要研究者,计划在中国、美国、欧洲等全球15个国家和地区的超过170家研究中心开展,招募约756例受试者。目前该研究已完成全球首例受试者入组(FPI)及首次给药,进展顺利,正在入组中。2023年12月,公司启动tifcemalimab用于治疗经典型霍奇金淋巴瘤(cHL)的随机、开放、阳性对照、多中心III期临床研究(研究编号JS004-009-III-cHL,研究登记号CTR20234002/NCT06170489)。该研究是tifcemalimab的又一项关键注册研究,也是BTL靶点药物在血液肿瘤领域的首个III期临床研究,旨在评价tifcemalimab联合特瑞普利单抗对比研究者选择的化疗用于抗PD-(L)1单抗难治性cHL的疗效和安全性,由北京大学肿瘤医院宋玉琴教授担任主要研究者,计划在国内约50个研究中心开展,招募约185例患者。此外,多项tifcemalimab联合特瑞普利单抗的Ib/II期临床研究正在中国和美国同步开展中,覆盖非小细胞肺癌、小细胞肺癌、黑色素瘤等多个瘤种。公司将在获得更多数据积累后,根据临床数据及与监管机构的沟通来进行后续注册临床研究的布局,以推动tifcemalimab联合特瑞普利单抗在更多瘤种中的应用和商业化。
问:公司2023年整体业绩情况?未来经营计划?
答:根据公司业绩预告,2023年,预计公司营业收入增长,亏损与上年同期相比有所减少,具体业绩情况以公司发布的2023年年度报告为准。公司在营业收入增加的同时加强各项费用管控,优化资源配置,聚焦更有潜力的研发管线,降本增效整体取得良好成效,核心管线亦维持高效推进。接下来,公司将在加快推进在研管线的研发进度及商业化进程的基础上,重点推进特瑞普利单抗针对大适应症和领先适应症的III期注册临床的数据读出以及其在全球范围内的上市申请进程,重点推进“全球新”(first-in-class)药物抗BTL单抗tifcemalimab等具有全球竞争力的核心产品的临床研发工作。在生产方面,公司计划进一步提升药物发酵产能利用率、探索新型生产工艺以进一步在保证药品质量的前提下提高生产成本优势。在商业化方面,公司将持续完善营销与商业化团队的建立,进一步提升销售能力,并积极探索与国内外优秀医药企业的合作,推动公司产品以更广阔的覆盖范围、更快的可及速度造福患者。公司管理层将进一步提升公司经营管理水平,不断提高公司核心竞争力、盈利能力和全面风险管理能力,努力实现公司降本、增效、提质,持续稳定经营。
问:商业化药品国内市场销售情况及未来预期?
答:公司商业化药品在国内市场的销售于2023年取得了积极进展。目前公司正在商业化的有特瑞普利单抗注射液(商品名拓益?)、阿达木单抗注射液(商品名君迈康?)和氢溴酸氘瑞米德韦片(商品名民得维?)三款药品。2023年公司营业收入预计增长,主要系商业化药品的销售收入与上年同期相比有所增长,公司自身造血能力得到进一步加强。2023年,公司核心产品拓益?用于可切除非小细胞肺癌患者围手术期治疗的新适应症上市申请获得NMP批准,用于晚期三阴性乳腺癌治疗、晚期肾细胞癌一线治疗、广泛期小细胞肺癌一线治疗的新适应症上市申请获得NMP受理,一线治疗黑色素瘤的III期临床研究达到主要研究终点。上述适应症中,一线肾癌、晚期三阴乳腺癌、非小细胞肺癌围手术期治疗均为公司进度领先且用药周期较长的适应症,将有助于未来在市场推广中取得先发优势,公司商业化团队亦将持续加强拓益?在国内市场的推广和医患教育。另外,2023年,拓益?新增3项适应症纳入《国家基本医疗保险、工保险和生育保险药品目录(2023年)》(国家医保目录),截至目前已有6项适应症纳入国家医保目录;民得维?用于轻中度新型冠状病毒感染(COVID-19)的成年患者的适应症首次纳入正式国家医保目录;君迈康?已获批的8项适应症继续纳入国家医保目录。新版国家医保目录于2024年1月1日起正式实施。随着已获批产品和适应症纳入国家医保目录后可及性的提高,以及未来更多产品和适应症的陆续获批,公司将持续加强商业化能力。
君实生物(688180)主营业务:创新药物的发现和开发,以及在全球范围内的临床研发及商业化。
君实生物2023年三季报显示,公司主营收入9.86亿元,同比下降19.04%;归母净利润-14.07亿元,同比上升11.78%;扣非净利润-13.59亿元,同比上升17.46%;其中2023年第三季度,公司单季度主营收入3.17亿元,同比上升16.31%;单季度归母净利润-4.09亿元,同比上升40.0%;单季度扣非净利润-3.88亿元,同比上升44.62%;负债率28.04%,投资收益-4486.65万元,财务费用-5534.36万元,毛利率65.85%。
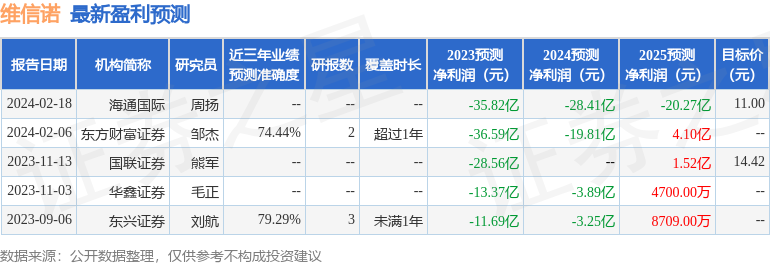
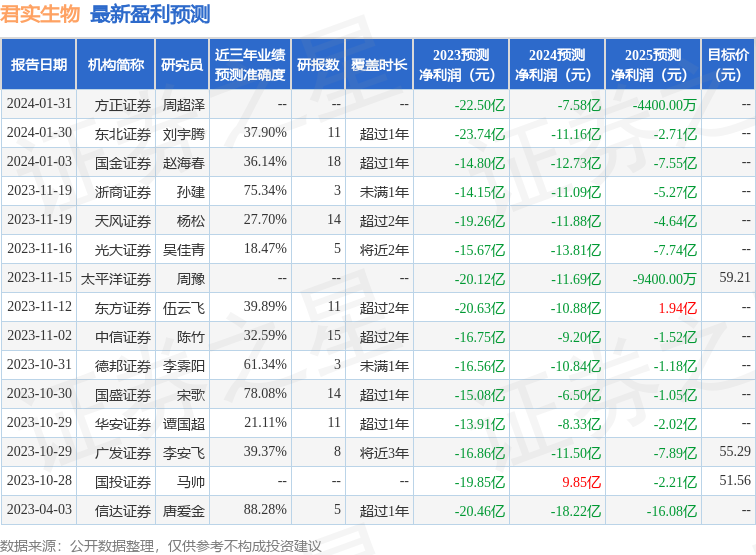
该股最近90天内共有10家机构给出评级,买入评级10家;过去90天内机构目标均价为55.29。
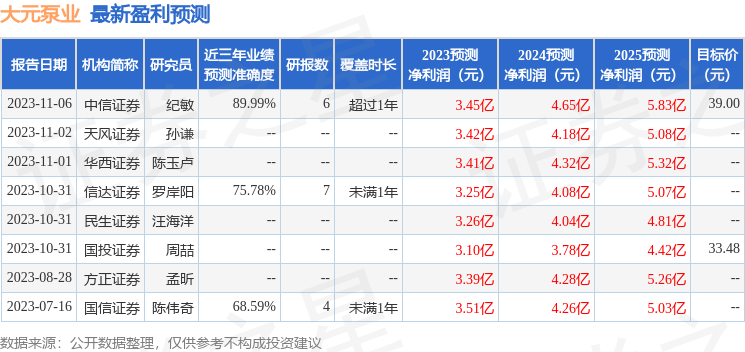
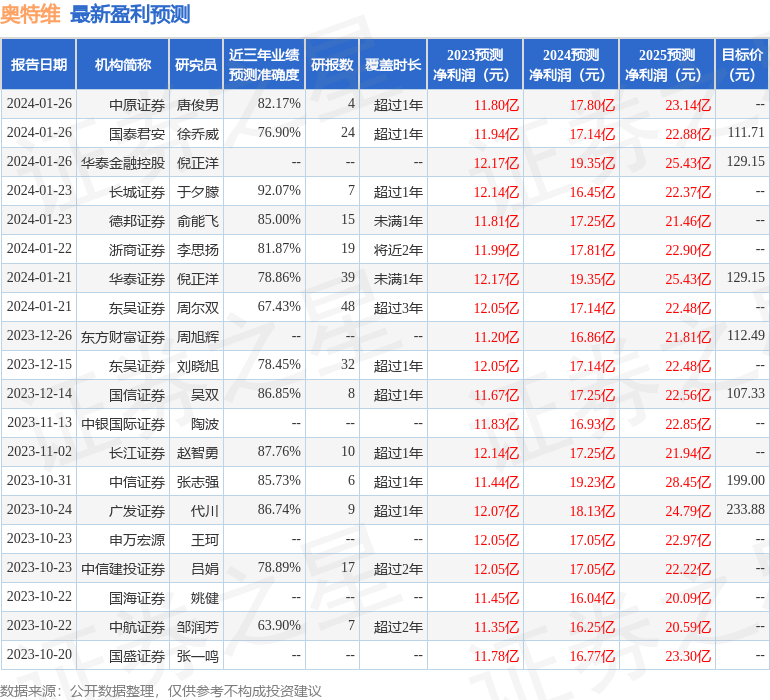
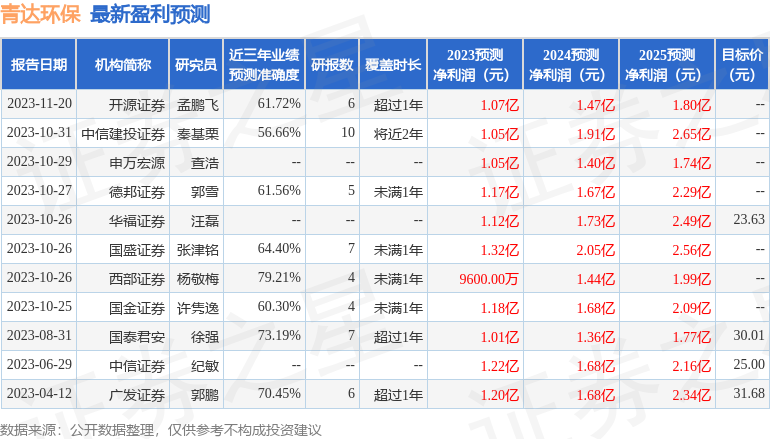
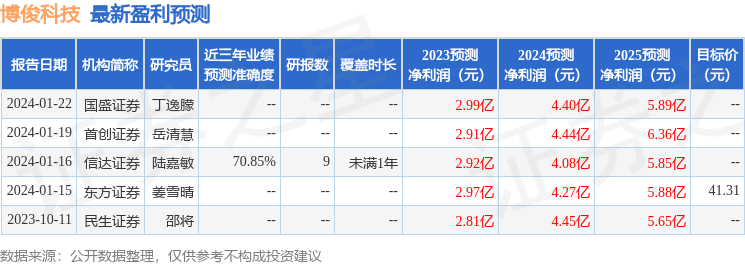
以下是详细的盈利预测信息:
融资融券数据显示该股近3个月融资净流入3.1亿,融资余额增加;融券净流入1019.95万,融券余额增加。
以上内容由根据公开信息整理,由算法生成,与本站立场无关。力求但不保证该信息(包括但不限于文字、视频、音频、数据及图表)全部或者部分内容的的准确性、完整性、有效性、及时性等,如存在问题请联系我们。本文为数据整理,不对您构成任何投资建议,投资有风险,请谨慎决策。