近期,聚焦于基因和细胞治疗的上海邦耀生物科技有限公司(以下简称"邦耀生物")与华东师范大学李大力教授及刘明耀教授团队合作,于2023年6月15日在Nature Biotechnology杂志上发文,报道开发了一系列新型腺嘌呤颠换编辑工具(AXBEs和ACBEs),为多元化的遗传操作和人类第二大类单碱基突变(SNVs)的基因治疗提供新的工具。这也是邦耀生物团队继2022年10月在国际著名学术期刊Nature Chemical Biology报道新一代精准安全的腺嘌呤碱基编辑器ABE9以及同年11月在国际著名学术期刊Nature Biotechnology报道高精度新型胞嘧啶碱基编辑系统Td-BEs后,一年不到的时间在单碱基编辑工具开发领域的又一重大技术突破。

邦耀生物Nature Biotechnology 发文
人类的遗传疾病主要由基因突变造成,约58%为单碱基突变(SNVs)。目前,不依赖DNA双链断裂和模板参与的单碱基编辑器(base editors)是治疗遗传病强有力的基因编辑工具。现有的碱基编辑技术CBEs(C-to-T),CGBEs(C-to-G), GBEs(C-to-G/C-to-A)和ABEs(A-to-G)可实现胞嘧啶转换/颠换编辑以及腺嘌呤的转换突变。由于缺少切除肌苷的内源DNA糖苷酶,ABEs产生的A-to-G产物纯度可达99%,但是不会发生腺嘌呤的颠换(A-to-C或A-to-T)。然而,仍有25%的人类单碱基突变遗传疾病需要精准的腺嘌呤颠换编辑(17%需要A-to-C,8%需要A-to-T)才能纠正,因此开发高效精准的腺嘌呤碱基编辑器具有重要意义。
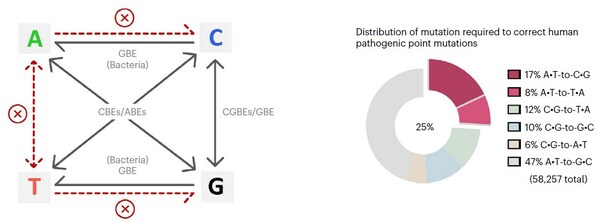
碱基编辑器介导碱基突变的种类及人类致病性点突变的分布
AXBEs:实现了广泛靶向基因组,扩大应用范围
碱基颠换需要依赖无嘌呤无嘧啶(AP)位点的创建,随后进行碱基切除修复途径(BER)而完成。鉴于内源糖苷酶的肌苷切除修复能力低效,邦耀生物及华东师大研究团队通过寻找其他潜在可将肌苷作为催化底物的酶,将其与腺嘌呤脱氨酶TadA-8e和nCas9融合。惊喜的发现当融合小鼠来源的烷基腺苷DNA糖苷酶(mAAG)实现了8.7%的A到Y(Y=C或T)的碱基颠换,将其命名为AXBE(X代表任意碱基)。为增加腺嘌呤颠换编辑效率并拓展靶向范围,基于结构导向的理性设计和筛选鉴定出mAAG中的两个关键突变(mAAG-EF)极大提高其底物肌苷的切除活性,基于此产生的AXBEv2介导更高效的A到Y编辑,甚至在非YAR-motif位点的颠换突变也显著提升,因此有效改善了颠换编辑的序列背景选择性。
ABE系统只能产生122种密码子和32种氨基酸的转换,而AXBEs可诱导腺嘌呤到其他三种碱基的变换,在ABE系统的基础上,能够产生独有的436种密码子和115种氨基酸突变,表明了可以广泛地靶向基因组,扩大应用范围,为分子进化、遗传筛选、谱系示踪等应用提供强有力的基因编辑工具。
ACBEs:精准、高效,治疗潜力巨大
为进一步减少严重的非目标碱基A到G突变,研究人员尝试将腺嘌呤脱氨酶改造以及采用Cas9嵌入的策略,从而使得A到G的编辑副产物大幅降低,该类型编辑器分别被命名为ACBE和ACBE-Q。ACBE最高可实现45%的A到C编辑以及73%的碱基颠换编辑,而ACBE-Q更加精准地编辑sgRNA的A4-A6位,精确度最高提高了171倍,且只产生背景水平的Cas9非依赖性脱靶事件(平均脱靶效率<0.3%),展现出较高的应用安全性。通过与先导编辑(prime editing)技术进行同位点的对比,发现ACBE可以更加高效的实现A-to-C的精确转换,而PE系统需要经过几十种参数组合筛选优化,但效率非常低同时会产生高比率的缺失突变。证明ACBE更加简便易行,而且效率方面具有显著优势。
此外研究表明,ACBE-Q在小鼠体内也展现出极高的编辑效率和精度。在构建杜氏肌营养不良小鼠疾病模型中,70%突变小鼠(21/30只)实现了靶位点A6到C的编辑,平均编辑效率为56%,A>C编辑纯度最高可达到99.8%,显示了其体内应用的巨大潜力。最后为了研究ACBEs的治疗潜力,研究者构建了携带STAT3 c.1145G>T(该热点突变引起复发性传染病)突变的稳转细胞系,ACBEs在目标位置引入了想要的A到C纠正编辑。结果显示,ACBEs能够在AT富集区域提前引入终止密码子扩大了基因调控的范围,并且mAAG与不同Cas变体的兼容性进一步扩大A到C的靶向范围,表明了其纠正人类第二大类致病性SNVs的巨大治疗前景。
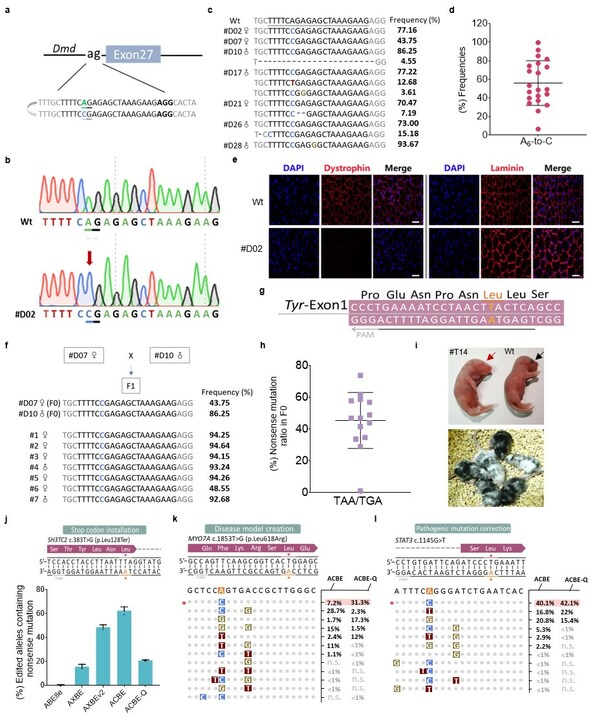
ACBEs在小鼠体内精确编辑以及在细胞系中模拟或纠正人类致病SNVs
论文共同通讯作者,邦耀生物联合创始人&副总裁李大力教授表示:"在本次研究中,新型腺嘌呤颠换编辑工具的开发为多元化的遗传操作和人类遗传疾病的基因治疗提供了新的策略。ACBEs可以有望纠正很多由于C·G到A·T单点突变造成的遗传疾病,例如,苯丙酮尿症、鸟氨酸转氨酶(OTC)缺乏导致的高氨血症等肝脏代谢疾病和血友病B。通过与PE系统的对比也表型在建立A-to-C的碱基颠换方面,ACBE具有更高效且简便易行的特点。总体来说,ACBEs的开发为碱基编辑的工具箱再添一名举足轻重的成员,可以说是碱基编辑技术的最后一块拼图,有望帮助人们战胜更广范围的遗传性疾病。"
邦耀生物突破不断,给人类疾病带来更优的治疗选择
邦耀生物作为一家全球最早进行基因编辑技术研发和应用的企业之一,自成立以来一直坚持技术创新,不仅不断克服行业壁垒进行多管线战略布局,同时致力于开发国际领先的基因编辑工具,获得具有自主知识产权的核心技术。目前,邦耀生物科学家团队在基因编辑工具开发、基因治疗地中海贫血等遗传疾病领域,已经取得很多重磅、突破性进展:
2022年11月,Nature Biotechnology发文,开发出高精度新型胞嘧啶碱基编辑系统"Td-CGBE/Td-CBEs";
2022年10月,Nature Chemical Biology发文,成功开发精准安全的新型腺嘌呤碱基编辑器"ABE9";
2022年8月,Nature Medicine发文,公布了详细的临床数据,邦耀生物BRL-101基因治疗地中海贫血症患儿脱离输血依赖已超过2年,并更为全面地解读了BRL-101治疗患者的疗效和安全性特征;2020年6月,Nature Biotechnology发文,开发一种全新的具有高特异性且安全的双功能碱基编辑器"A&C-BEmax";
2020年5月,Nature Cell Biology发文,报道自主研发的hyCBEs系列工具拥有更高的编辑活性和更宽的编辑窗口,对于β血红蛋白病的治疗具有更大的优势;
2020年3月,Nature Medicine发文,证明单碱基编辑技术可以靶向BCL11A的红系增强子原件激活胎儿期血红蛋白,或者编辑β血红蛋白基因的特定突变,有望通过编辑自体造血干细胞治疗包括β-地中海贫血在内的遗传性血液疾病;
2020年1月,Cell Research发文,率先证明单碱基编辑器编辑技术靶向HBG启动子激活胎儿期血红蛋白的表达对于治疗β-地中海贫血的可行性与有效性;
2019年3月,Nature Medicine发文,发现利用基因编辑技术靶向编辑BCL11A红系增强子,会重新开启γ珠蛋白表达,代替有缺陷的β珠蛋白,有望达到根治β-地中海贫血目的;
2016年5月,EMBO Molecular Medicine发文,全球首次利用CRISPR基因编辑治疗血友病。
可以说,回顾邦耀生物在碱基编辑器及其在基因治疗遗传疾病中的一系列突破性进展,为基因治疗领域发展提供了助力。未来,邦耀生物将继续与业界科学家一起努力,不断优化基因编辑系统,解决当下挑战;并仍将以基因编辑技术为核心驱动力,不断克服行业壁垒进行多管线战略布局,加速推进创新药物的转化与落地,为广大患者带来更多元化、更优的治疗选择。






