消息,2024年5月31日泽璟制药(688266)发布公告称公司于2024年5月21日召开分析师会议,银华基金、boyu capital、华宝基金、永赢基金、浙商基金、汇丰晋信、摩根基金、东吴基金、清池资本、创金合信、大成基金、中银基金、国寿资产、交银施罗德、华夏基金、东方红、金鹰基金、汇添富基金、长城基金、景顺长城、平安基金、安进基金、农银汇理、国投瑞银、泰康资产、富国基金、建信基金、工银瑞信、鹏华基金、博时基金参与。
具体内容如下:
问:请公司ZG005的作用机制及在ASCO发布的临床研究数据情况?
答:ZG005拥有双靶向阻断PD-1和TIGIT的作用,既可以通过有效阻断PD-1与其配体PD-L1的信号通路,进而促进T细胞的活化和增殖;又可以有效阻断TIGIT与其配体PVR等的信号通路,促使PVR结合CD226产生共刺激激活信号,进而促进T细胞和NK细胞的活化和增殖,并产生两个靶点被同时阻断后的协同增强免疫系统杀伤肿瘤细胞的能力。根据公开查询,ZG005是全球率先进入临床研究的同靶点药物之一,目前全球范围内尚未有同类机制药物获批上市。ZG005在2024年美国临床肿瘤学会(SCO)年会发布的I/II期临床研究数据及最新进展截至2024年4月16日,ZG005-001项目剂量递增阶段已完成,共入组32例受试者;剂量扩展阶段正在进行中,已入组47例受试者。79例受试者中,43%的受试者既往曾接受过至少两线抗肿瘤药物系统治疗,48%的受试者既往接受过PD-1/PD-L1抑制剂治疗。有效性方面,可评估疗效的21例宫颈癌受试者(3 mg/kg组1例、10 mg/kg组12例、20 mg/kg组8例)中,有2例完全缓解(CR)、7例部分缓解(PR)和8例疾病稳定(SD);客观缓解率(ORR)为43%(9/21),疾病控制率(DCR)为81%(17/21),特别是目标剂量20 mg/kg组的客观缓解率(ORR)达到63%。9例获得客观缓解(CR/PRs)的宫颈癌受试者中,2例既往接受过PD-1/PD-L1抑制剂治疗。1例3 mg/kg组宫颈癌受试者,其肿瘤病灶自首次给药后持续缩小,现已接受ZG005治疗超过77周,靶病灶总径较基线缩小60.9%。11例宫颈癌受试者在首次肿瘤评估时即出现肿瘤缩小。截至数据截止日期,有16例受试者仍正在接受治疗。安全性方面,63.3%(50/79)的受试者出现了与治疗相关的不良事件(TREs),绝大多数严重程度为1或2级。综上,ZG005呈现出良好的耐受性和安全性及良好的抗肿瘤疗效,特别是在接受20 mg/kg剂量治疗的晚期宫颈癌患者中初步结果显示疗效更优。现有已获得的有效性和安全性数据支持ZG005在晚期宫颈癌等多瘤种中开展进一步的临床研究。
问:请公司ZGGS18的作用机制及在ASCO发布的临床研究数据情况?
答:ZGGS18可以特异性地结合血管内皮生长因子(VEGF)和“捕获”转化生长因子-β(TGFβ),起到抑制肿瘤新生血管形成和降低肿瘤转移发生等协同抑制肿瘤生长的多重作用。另外,ZGGS18也可以改善和调节肿瘤微环境,从而可以和抗PD-1/L1抗体、公司正在开展临床研究的抗PD-1/TIGIT双特异性抗体ZG005等肿瘤免疫治疗药物联合增强肿瘤杀伤作用。ZGGS18在2024年美国临床肿瘤学会(SCO)年会发布的I/II期临床研究数据及最新进展截至2024年4月23日,共入组21例受试者;其中男性14例,女性7例;ECOG评分1分16例,0分5例;所有受试者既往均至少接受过一线治疗。有效性方面,共19例疗效可评估受试者,ORR和DCR分别为5.3%和42.1%。6 mg/kg剂量组1例子宫内膜癌患者已接受了22次ZGGS18治疗。20 mg/kg剂量组1例既往接受过四线治疗失败的直肠癌患者,在第18周肿瘤评估时靶病灶缩小39.8%,达到PR。安全性方面,81.0%(17/21)例受试者发生了治疗相关不良事件(TRE),绝大多数为1或2级。综上,ZGGS18呈现出良好的耐受性和安全性以及抗肿瘤疗效,支持ZGGS18在晚期肿瘤中开展进一步的临床研究。
问:请介绍ZG006的产品特点和研发进展?未来进入II期后将针对哪些适应症?
答:ZG006是全球第一个针对DLL3表达肿瘤的三特异性抗体(CD3×DLL3×DLL3),是全球同类首创(First-in-Class)分子形式,具有成为同类最佳(Best-in-Class)分子的潜力。目前全球只有安进公司的同靶点药物MG757(CD3/DLL3双抗)提交了美国FD上市申请,但还未有针对DLL3靶点的新药获批上市。ZG006衔接肿瘤细胞和T细胞,将T细胞拉近肿瘤细胞,从而利用T细胞特异性杀伤肿瘤细胞。ZG006用于治疗晚期实体瘤的临床试验申请已获FD和NMP批准,目前处于I期的剂量爬坡阶段,入组进度顺利,符合预期。基于DLL3是一种在正常细胞中极低表达,而在小细胞肺癌(SCLC)、神经内分泌癌等肿瘤细胞中高表达的肿瘤特异性抗原,公司将重点在小细胞肺癌、神经内分泌癌等领域进行开发和研究。
问:重组人凝血酶的定价情况、合作和销售进展?
答:重组人凝血酶目前的定价是1,016元/支(5000IU/支)。公司与远大生命科学子公司达成了独家商业推广合作,合作方在围手术期及止血领域深耕多年,在止血药品市场推广和销售方面具有丰富的经验。双方合作顺利推进中,截至2024年3月公司已收到重组人凝血酶商业化合作首付款2.6亿元人民币。今年第一季度主要开展销售前的相关准备,目前重组人凝血酶已经发货销售,远大的销售团队正在积极开展重组人凝血酶市场销售工作。
问:请介绍一下美国研发中心的主要情况?
答:公司的美国研发中心以GENSUN为主体,GENSUN是一家研发创新性蛋白质治疗药物的肿瘤免疫治疗公司,创始人和研发团队拥有丰富的大分子药物研发国际化经验。泽璟和子公司GENSUN已经建立了研发肿瘤免疫治疗抗体药物的技术平台,目前在研的双特异和三特异治疗抗体包括抑制多个免疫检查点途径的候选药物、阻断当前免疫检查点治疗药物的多个关键耐药途径的候选药物、同时阻断血管生成和免疫检查点途径的候选药物以及释放细胞毒性细胞从而直接杀死肿瘤细胞的靶向免疫疗法。抗体药物技术平台的建设和研发项目的推进,有利于增强公司的核心竞争力,同时提升公司国际化研发水平。
问:杰克替尼在治疗特应性皮炎和白癜风方面的进展?
答:在治疗特应性皮炎方面,杰克替尼口服和外用的剂型都在开发,其中杰克替尼片正在开展中重度特应性皮炎的III期临床试验,杰克替尼乳膏正在开展治疗轻中度特应性皮炎(外用)的II期临床试验;在治疗白癜风方面,杰克替尼乳膏和杰克替尼片剂用于治疗12岁及以上青少年和成人非节段型白癜风患者的临床试验已经获得NMP批准。
问:重组人促甲状腺激素目前进展情况、市场预期及应用场景?
答:公司开展了注射用重组人促甲状腺激(rhTSH)的两项III期临床研究,其中甲状腺癌患者术后辅助诊断的III期临床研究达到了方案预设的主要终点,公司正在准备生物制品上市许可申请资料,积极推进rhTSH的上市进程。同时,公司正在开展该产品用于分化型甲状腺癌患者术后辅助放射性碘清甲治疗的III期临床研究,目前进展顺利。近年来,甲状腺癌的发病率呈持续上升趋势,根据国家癌症中心发布的2022年中国恶性肿瘤流行病权威数据,甲状腺癌2022年新发患者46.61万人,仅次于肺癌及结直肠癌,为中国第三大高发的恶性肿瘤。应用场景对于甲状腺癌患者诊疗过程一般包括手术切除、I-131放疗、系统治疗等。分化型甲状腺全切或近全切手术后的诊疗,I-131治疗和定期随访是获得更长生存的关键手段之一。外源性注射人重组促甲状腺素是比现有甲状腺素撤除(THW)更加快速和安全地提高甲状腺癌诊断和治疗水平的方法。相较于现有的甲状腺素撤除(THW)方法(如停用优甲乐2~4周),注射重组人促甲状腺激素提升TSH时间更快(仅需2天左右),并且避免甲减导致体重增加、畏寒等不良反应以及相关并发症的恶化,降低肿瘤进展风险,因此是临床上甲状腺癌诊断和治疗的更优选择。
泽璟制药(688266)主营业务:化学新药及生物新药的研发、生产及销售。
泽璟制药2024年一季报显示,公司主营收入1.08亿元,同比上升0.12%;归母净利润-3949.94万元,同比上升30.98%;扣非净利润-4250.29万元,同比上升33.51%;负债率48.44%,投资收益50.59万元,财务费用-696.08万元,毛利率93.4%。
该股最近90天内共有12家机构给出评级,买入评级11家,增持评级1家;过去90天内机构目标均价为63.04。
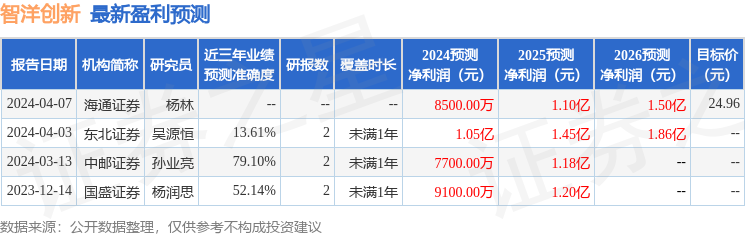
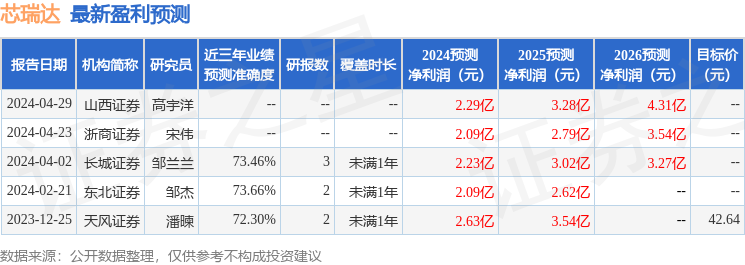
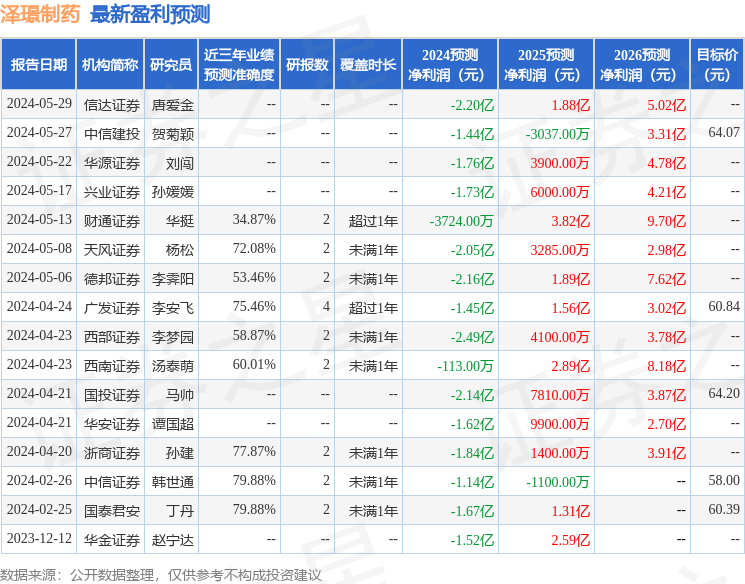
以下是详细的盈利预测信息:
融资融券数据显示该股近3个月融资净流出3526.09万,融资余额减少;融券净流出257.98万,融券余额减少。
以上内容由根据公开信息整理,由算法生成(网信算备310104345710301240019号),与本站立场无关,如数据存在问题请联系我们。本文为数据整理,不对您构成任何投资建议,投资有风险,请谨慎决策。