消息,2024年5月27日亚虹医药(688176)发布公告称国投证券、长盛基金于2024年5月24日调研我司。
具体内容如下:
问:APL-1702何时获批?
答:公司已于近日公告关于产品PL-1702(通用名盐酸氨酮戊酸己酯软膏光动力治疗系统)拟用于治疗18岁及以上排除原位癌的经组织学证实的宫颈高级别鳞状上皮内病变(High-Grade Squamous Intraepithelial Lesion, HSIL)患者的上市申请获得受理,关于后续进展,公司将严格按照有关规定及时履行信息披露义务。
问:APL-1702未来如何定价?
答:目前针对宫颈癌前病变患者以传统手术治疗方法为主,最常见的治疗方式包括宫颈环形电切术(LEEP)和冷刀锥形切除术(CKC),尚未有非手术治疗产品上市。PL-1702未来会参考传统手术治疗的综合费用、产品自身的创新性和药物经济学评价、患者支付能力等多方面因素进行定价。
问:APL-1702商业化团队组建情况如何了?
答:公司非常看好PL-1702这个品种的市场潜力,为了更好专注PL-1702商业化和扩大妇科管线,公司于2024年年初设立女性健康事业部,并由该事业部负责核心产品PL-1702的国内商业化以及扩大在妇科的产品管线,建立亚虹在妇科市场的领导地位。女性健康事业部负责人曹少华女士、市场部核心成员已经到岗,团队核心成员均拥有妇科领域丰富工作经验及一线跨国药企多年工作经历。
问:APL-1202临床试验目前的进展如何?
答:PL-1202口服联合替雷利珠单抗作为MIBC(肌层浸润性膀胱癌)新辅助治疗的Ⅱ期临床试验(以下简称“NTICIPTE”)已经完成所有受试者入组,预计2024年三季度读出Ⅱ期顶线数据。nticipate研究Ⅱ期临床试验期中分析结果显示PL-1202和替雷利珠单抗联用治疗组,18例可评估疗效的受试者中7例达到pCR,为7/18(39%);替雷利珠单抗单药治疗组,14例可评估疗效的受试者中3例达到pCR,为3/14(21%)。基于NTICIPTE研究Ⅱ期试验取得了积极的临床疗效信号并展示出良好的安全性,公司将优先考虑满足中国晚期膀胱癌患者未被满足的临床需求,拟在中国晚期膀胱癌人群中开展PL-1202联合免疫检查点抑制剂的临床研究,并尽快与国家药品监督管理局药品审评中心(CDE)沟通递交临床试验申请;同时在NMIBC(非肌层浸润性膀胱癌)领域,在海外探索开展BCG无反应、伴有或不伴有CIS原位癌的人群中的临床研究。PL-1202单药治疗未经治疗的中危NMIBC临床研究尚在持续招募受试者。现有数据显示,PL-1202具有良好的安全性和耐受性,且PL-1202单药组和化疗灌注治疗组无复发比例相似。公司将进一步分析该研究的临床结果,分析、评估和确认后续开发策略。
亚虹医药(688176)主营业务:专注于泌尿生殖系统(UrogenitalSystem)肿瘤及其它重大疾病领域,致力于为患者提供诊疗一体化解决方案。
亚虹医药2024年一季报显示,公司主营收入2431.95万元,同比上升106217.71%;归母净利润-8284.82万元,同比下降31.64%;扣非净利润-9322.58万元,同比下降25.86%;负债率10.08%,投资收益795.12万元,财务费用-1075.19万元,毛利率78.97%。
该股最近90天内共有1家机构给出评级,买入评级1家;过去90天内机构目标均价为13.7。
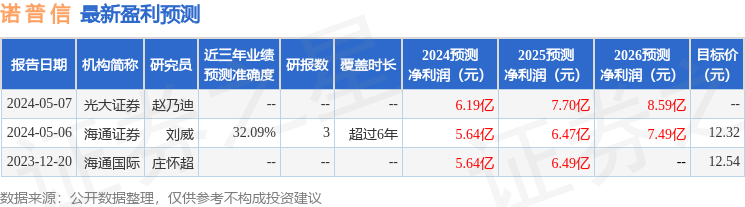
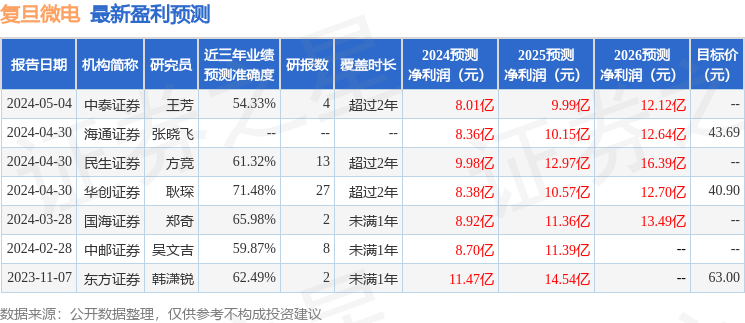
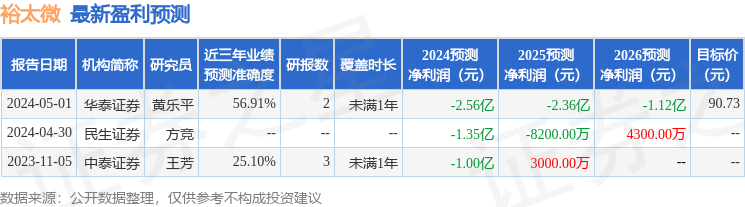
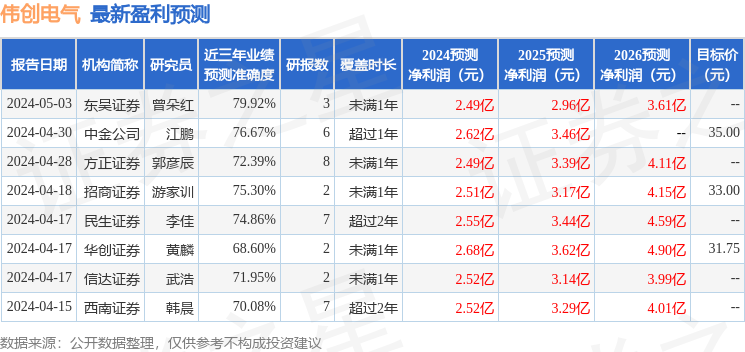
以下是详细的盈利预测信息:
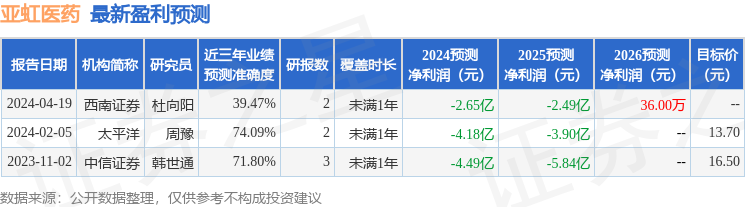
融资融券数据显示该股近3个月融资净流入1171.24万,融资余额增加;融券净流出16.03万,融券余额减少。
以上内容由根据公开信息整理,由算法生成(网信算备310104345710301240019号),与本站立场无关,如数据存在问题请联系我们。本文为数据整理,不对您构成任何投资建议,投资有风险,请谨慎决策。